Stai frequentando il semestre filtro e fatichi a tenere il passo con le lezioni di Chimica?
Studiare chimica all’università non è certo una passeggiata: la materia richiede delle solide basi matematiche e fisiche, oltre che una buona conoscenza dei concetti base della chimica.
Oggi Atena Academy proverà a renderti più chiaro lo studio delle teorie acido-base e dell’autoprotolisi dell’acqua.
Si tratta di due ambiti dello studio della chimica fondamentali anche in Medicina:
- Le teorie acido-base, infatti, spiegano come il corpo umano regola il suo pH per mantenere un equilibrioottimale e la loro conoscenza risulta importante anche per diagnosticare e trattare disturbi acidometabolici e respiratori;
- L'autoprotolisi dell'acqua è fondamentale perché permette di stabilire la scala del pH, un parametro essenziale per il corretto funzionamento delle reazioni chimiche all'interno delle cellule e, quindi, per l'equilibrio acido-base del corpo.
Iniziamo con le teorie acido-base.
Le principali teorie sono tre: la teoria di Arrhenius, la teoria di Bronsted-Lowry e la teoria di Lewis.
Vediamo insieme brevemente come potremmo schematizzarle per facilitarne lo studio
Teorie acido-base
Teoria di Arrhenius:
Fu il primo a proporre una teoria acido-base a partire dal comportamento di queste sostanze in acqua. Un acido è una sostanza che, sciolta in acqua, provoca un aumento della concentrazione degli ioni H+.
HCl(aq)→ H+(aq) + Cl-(aq)
Una base è una sostanza che, sciolta in acqua, provoca un aumento della concentrazione degli ioni OH- (ione idrossido).
NaOH(aq) → Na+ (aq) + OH- (aq)
La teoria di Arrhenius è limitata a soluzioni acquose e non considera acide o basiche sostanze che non contengano ioni OH- e H+ (per esempio NH3, ovvero l’ammoniaca, è una base nonostante non abbia ioni idrossido).
Teoria Bronsted-Lowry:
Le reazioni acido-base sono considerate come reazioni di trasferimento protonico (H+):
- Un acido è una specie che dona un protone;
- Una base è una specie che accetta un protone.
Secondo questa teoria la ionizzazione di HCl in acqua è vista come il trasferimento di un protone da HCl ad H2O:
HCl (acido) + H2O (base) → H3O+ (Acido coniugato alla base) + Cl- (Base coniugata all’acido)
Analogamente una base posta in acqua accetta un protone dall’acqua liberando ioni OH-.
NH3 accetta un protone dall’acqua ed è quindi una base, mentre H2O cede il protone ed è un acido.
NH3 (base) + H2O(acido) -> NH4 + (acido coniugato alla base) + OH- (base coniugata all’acido)
H2O si comporta da base con HCl (accetta un protone formando H3O+), ma si comporta da acido con NH3 (cede il protone formando OH-).
Specie di questo tipo, che possono agire sia come acido che come base in dipendenza dell’altro reagente, vengono dette anfotere.
Teoria di Lewis:
Spiega perché alcune sostanze possono essere considerate acidi o basi pur non avendo atomi di idrogeno.
Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia di elettroni solitaria:
- Un acido di Lewis è una specie che può formare un legame covalente accettando una coppia di elettroni da un’altra specie.
- Una base di Lewis è una specie che può formare un legame covalente donando una coppia di elettroni ad un’altra specie.
Ovviamente questi brevi schemi non devono essere sostituiti allo studio sui libri e sulle dispense, ma vogliono essere un valido aiuto e sostegno per la comprensione di queste teorie e delle loro differenze.
Passiamo ora a vedere in breve cos’è l’autoprolisi dell’acqua e quali sono le sue caratteristiche:
AUTOPROTOLISI DELL’ACQUA E PH
L'autoprotolisi dell'acqua è il processo in cui due molecole d'acqua reagiscono tra loro, formando ioni idrossonio (H3O+) e ioni idrossido (OH-).
Questa auto-ionizzazione è un equilibrio dinamico che avviene anche nell'acqua pura e determina il suo pH neutro, dove le concentrazioni di H3O+ e OH- sono uguali (10−7 M a 25°C).
L’acqua è considerata una sostanza anfiprotica perché agisce sia da acido (donando un protone) che da base (accettando un protone) in questa reazione.
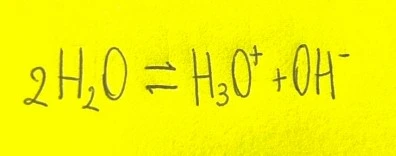
Il prodotto delle concentrazioni degli ioni idrossonio (H3O+) e idrossido è una costante, nota come Kw, che vale 1,0 × 10−14 a 25°C.
Questo valore è una misura dell'equilibrio di autoprotolisi.
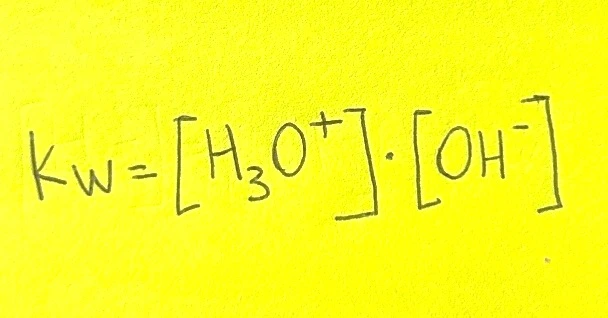
Se dovessimo trovare la concentrazione [] degli ioni, se sono nella stessa quantità, faremo:
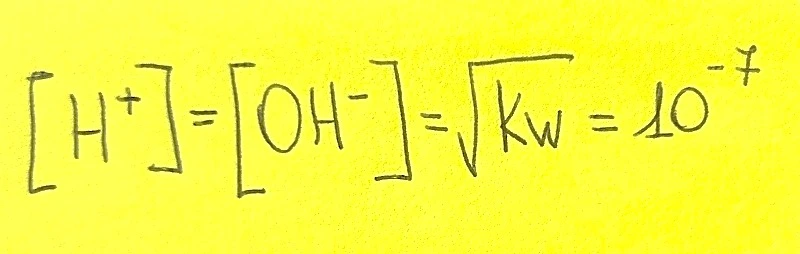
-Se [H+]>[OH-] la soluzione è acida
-Se [H+]<[OH-] la soluzione è basica
-Se [H+]= [OH-] la soluzione è neutra
Da qui constatiamo che possiamo avere una scala logaritmica di acidità o basicità da 0 a 14, semplicemente facendo
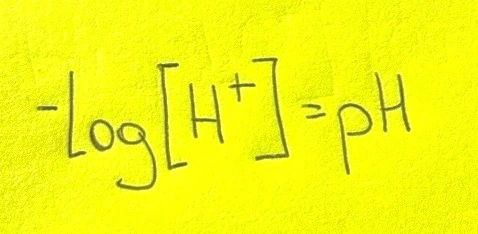
Se al posto di [H+] usiamo [OH-] otteniamo il pOH. Per passare da pOH a pH e viceversa basta sottrarre 14 al termine noto.
Se hai ancora dubbi i tutor di Atena Academy sono pronti ad aiutarti!
Puoi contattarci via e-mail, fissare la tua prima lezione gratuita e iniziare subito le tue lezioni.
Ti ricordiamo che sono attivi i nostri pacchetti PROMO per il semestre filtro, ideati per venire incontro agli studenti che a novembre e dicembre dovranno sostenere i 3 esami di sbarramento (Fisica, Chimica e Biologia).
Puoi trovare i pacchetti PROMO sul nostro sito fino alla fine del mese di Ottobre, quindi affrettati!